奥精医疗首发上会拟募资7.89亿 6家控股子公司均未实现盈利

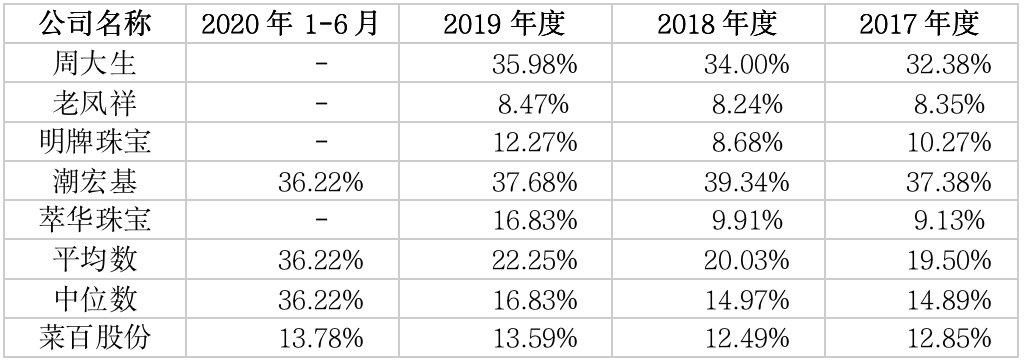
报告期内,奥精医疗的(年化)应收账款周转率分别为6.89次/年、5.95次/年、9.04次/年、4.69次/年,同行业可比上市公司应收账款周转率平均数分别为83.12(次/年)、54.98(次/年)、65.29(次/年)、10.86(次/年)。
奥精医疗表示,同行业可比公司中佰仁医疗由于采取先款后货的销售模式(即经销商预付货款后发出货物),故应收账款周转率远高于同行业其他可比公司;剔除了佰仁医疗的影响后,最近三年及一期同行业可比公司(年化)应收账款周转率平均数分别为5.90次/年、5.45次/年、4.87次/年、3.75次/年。

2020年6月末存货1337.16万元
2017年末、2018年末、2019年末、2020年6月末,奥精医疗存货价值分别为1552.29万元、1253.45万元、749.32万元、1337.16万元,占各期末流动资产的比例分别为6.01%、3.38%、1.53%、2.83%。

报告期各期内,奥精医疗存货周转率分别为(次/年)1.16、1.48、2.88、1.55,同行业可比上市公司存货周转率(次/年)分别为1.64、1.42、1.11、0.85。
奥精医疗表示,2017年、2018年,公司的存货周转率与同行业可比上市公司的平均水平较为接近;2019年,公司加强了库存管理,存货周转率有所加快。2020年,由于新型冠状病毒疫情影响,存货周转率有所放缓。

管理费用率高于同行业可比公司的平均水平
报告期内,公司管理费用主要由职工薪酬、折旧与摊销费、股份支付、服务费等组成。
报告期内,奥精医疗管理费用分别为2,371.51万元、4319.61万元、3808.04万元、1346.42万元。由于2018年确认了1778.22万元的股份支付金额,导致2018年度管理费用相对较高。剔除股份支付影响外,公司管理费用分别为1774.14万元、2541.39万元、3246.08万元、1346.42万元。
奥精医疗表示,报告期,公司管理费用率分别为25.95%、34.92%、22.59%、32.34%,剔除股份支付外,管理费用率分别为19.42%、20.55%、19.25%、32.34%,公司管理费用率高于同行业可比公司的平均水平,主要系公司尚处于发展阶段、经营规模相对较小、规模效应相对不足所致。
报告期内,公司管理费用率分别为25.95%、34.92%、22.59%及32.34%,同行业可比公司平均管理费用率为14.09%、11.62%、10.12%及8.03%,公司管理费用率高于同行业可比公司的平均水平,主要原因如下:报告期内,公司股份支付金额较大。剔除股份支付影响后,管理费用占比仍较高主要系规模效应不足及实际经营需要。

曾受到与产品质量相关的行政处罚
公司所在行业为医疗器械行业,产品的安全性和稳定性对患者的生命健康至关重要。报告期内奥精医疗曾受到与产品质量相关的行政处罚。奥精医疗称,如产品未来出现质量问题或因产品使用不当引起医疗纠纷或事故,将对公司的经营发展产生不利影响。
2018年9月12日,由于奥精医疗生产的人工骨修复产品尺寸与成分含量不符合医疗器械注册产品标准要求,公司被北京市海淀区食品药品监督管理局罚款54.95万元。2020年6月23日,公司违反了《医疗器械监督管理条例》第二十四条第一款以及《医疗器械生产监督管理办法》第四十条的规定,北京市海淀区市场监督管理局对公司作出没收人工骨修复材料69个、罚款14.5万元的行政处罚。
奥精医疗招股书披露称,2018年9月12日,北京市海淀区食品药品监督管理局对公司作出《行政处罚决定书》((京海)食药监械罚【2018】101029号),由于公司生产的人工骨修复产品尺寸与成分含量不符合医疗器械注册产品标准要求,认定公司违反了《医疗器械监督管理条例》第二十四条第一款的规定,并根据《医疗器械监督管理条例》第六十六条给予公司罚款54.95万元的行政处罚。
所涉批次产品(以下简称“该批次产品”)成分含量不合格主要系该批次产品在“溶解原料羟基磷灰石”的生产工序中,由于操作人员系新入职员工,对于操作方法不够熟悉,未严格按照操作指导书中的步骤进行称量,导致羟基磷灰石含量存在偏差;尺寸不合格主要系该批次产品规格表规定为Re-7(L16mm×W16mm×H6mm),在产品进行“切割”工序时,有三名操作人员同时操作,其中一名操作人员误将产品规格识别为Re-6(L15mm×W15mm×H4mm)规格尺寸,导致该批次产品尺寸存在不合格情况。
2020年6月23日,北京市海淀区市场监督管理局对公司作出《行政处罚决定书》((京海)市监械罚[2020]100177号),认定公司违反了《医疗器械监督管理条例》第二十四条第一款以及《医疗器械生产监督管理办法》第四十条的规定,并根据《医疗器械监督管理条例》第六十六条以及《医疗器械生产监督管理办法》第六十六条的规定对公司作出没收人工骨修复材料69个、罚款14.5万元的行政处罚。
在与北京市医疗器械检验所沟通测量方法的过程中,发行人认为北京市医疗器械检验所测量方法与发行人申请国械注准20143132075产品在申请注册时的测量方法上存在差异,不合格系检验方法存在差异所致。
鉴于此,发行人于2019年9月将该批次产品中抽取50盒送至四川医疗器械生物材料和制品检验中心检测,四川医疗器械生物材料和制品检验中心系发行人医疗器械产品(包括国械注准20143132075产品)的注册检验机构,对发行人医疗器械注册产品的结构及测量方法更为熟悉。四川医疗器械生物材料和制品检验中心于2020年1月16日出具检验报告,检验结果为该批次产品符合申请人提供的《人工骨修复材料》产品技术要求。
人工骨修复材料被北京药监局抽检“不合格”
2020年1月9日,北京市药品监督管理局发布的《北京市药品监督管理局2019年下半年北京市医疗器械质量安全公告》显示,2019年,北京市药品监督管理局根据《2019年北京市“两品一械”抽检工作实施方案》,对全市医疗器械生产企业开展了监督抽检,北京奥精医药科技有限公司(奥精医疗的曾用名)的人工骨修复材料SM-S20190427/20190403101被抽检不合格。


生产项目曾存在未办理环评手续的风险被行政处罚
奥精医疗招股书披露称,公司生产项目曾存在未办理环评手续的风险。
奥精医疗指出,公司位于北京市北京经济技术开发区地盛东路1号院2幢的研发及生产建设项目由于存在配套建设的固体废物污染环境防治设施建成后未经验收,主体工程即投入生产使用的情形,于2020年6月被北京经济技术开发区管理委员会处以罚款1万元的行政处罚。
截至招股说明书签署日,为完善上述瑕疵,公司已停止上述项目的研发及生产,并将该项目资产转让给北京奥精康健,由北京奥精康健继续办理环评批复手续。根据北京经济技术开发区综合执法局出具的证明,相关手续办理完毕后,上述项目可以继续进行研发和生产。同时,发行人已开始使用位于北京市大兴区中关村科技园区大兴生物医药产业基地永旺西路26号院2号楼的自有经营场所进行相关的研发及生产。
截至招股说明书签署日,北京奥精康健已取得北京经济技术开发区行政审批局出具的《关于北京奥精康健科技有限公司奥精康健人工骨修复材料项目环境影响报告表的批复》,并已完成建设项目环境保护设施验收工作。
2020年6月末,与上述项目相关的固定资产、长期待摊费用等主要资产合计约为180万元。如果上述项目无法完成环评审批手续,或公司主动放弃上述项目,公司将面临一定的资产减值风险,进而对公司的经营业绩造成不利影响。
涉及产品责任纠纷
天眼查显示,奥精医疗涉及产品责任纠纷。北京市海淀区人民法院于2020年10月13日宣判。案件名称是清华大学玉泉医院、奥精医疗科技股份有限公司产品责任纠纷一审民事其他文书,文书正文暂未公开。
此前,北京奥精医药科技有限公司涉侵害实用新型专利权纠纷。不过,原告胡晓予、朗思佳(北京)医疗科技开发有限公司均已撤诉。

责任编辑:hnmd004
- 全球观热点:甘肃酒泉属于哪个市?酒泉的经2023-06-14
- 环球百事通!意大利对法国世界杯谁赢了?在2023-06-14
- 鬼哭狼嚎是贬义词吗?暴跳如雷是贬义词吗?2023-06-14
- 公积金卡和工资卡可以是一张吗?公积金可以2023-06-14
- 每日聚焦:追星的人是什么心态?追星有什么2023-06-14
- 茶黄金是什么东西?大红袍属于哪个茶类? 2023-06-14
- 什么是名义利率? 名义利率和实际2023-06-14
- 天天消息!tp-link路由器怎么样?tp-link路2023-06-14
- 大盘股和板块股的区别是什么?大盘股上市对2023-06-14
- 怎么买一个合适的外接闪光灯?使用外接式闪2023-06-14
- 计算机启动修复要多久?启动修复可以强制2023-06-14
- 每日消息!电脑显卡风扇转速怎么调?怎么在B2023-06-14
- 纤体咖啡有副作用吗?咖啡喝多了对身体有什2023-06-14
- 基金清盘是不是赔惨了?基金一直跌会被清盘2023-06-14
- 美股的钱怎么转回国内?为什么中国人不能买2023-06-14
- 购买空气炸锅需要注意哪些问题?如何清洁空2023-06-14
- 中国农业大学是211还是985?农业大学是冷门2023-06-14
- 焦点滚动:澳大利亚主帅:世界杯前43分钟成2023-06-14
- 鸡蛋怎么孵化成小鸡?人工孵鸡蛋最简单的方2023-06-14
- 6月13日四川发布山洪灾害蓝色预警2023-06-14
- 五月天是什么时候出道的?五月天哪首歌曲最2023-06-14
- 天天热点评!电竞显示器怎么选?哪个电竞显2023-06-14
- 股票为什么会产生异常波动?尾盘拉升第二天2023-06-14
- 劳动法年假规定怎么休?劳动法年假补偿标准2023-06-14
- win10怎么取消开机密码?win10密码过期进不2023-06-14
- 如何升级客户端版本?手机客户端怎么打开?2023-06-14
- 世界快看点丨WIN10右下角天气怎么关?win102023-06-14
- 喝咖啡不能提神怎么回事?喝咖啡一次喝多少2023-06-14
- 清仓和半仓有什么区别?北交所中签100股能赚2023-06-14
- 申购新股最多可以配多少个号?新股申购配号2023-06-14